
26. Особенности горения жидкого топлива и основы его расчета
Горение - это химический процесс окисления горючих компонентов топлива, сопровождающийся интенсивным выделением теплоты.
Известно, что при низких температурах наличие топлива и воздуха (окислителя) не обеспечивает их химического соединения, называемого горением. Горение начинается только после того, как частицы прогрелись до температуры, обеспечивающей им энергию активации Е, достаточную для вступления в реакцию,
График на рис. 82 иллюстрирует энергию реакции и активации. Частицы топлива и окислителя, обладающие начальным энергетическим уровнем Н, должны приобрести энергию активации. Для достижения энергетического уровня А, при котором реакция будет идти самопроизвольно, необходимо предварительно преодолеть энергетический барьер, равный разности энергетических уровней А и Н, после чего начинается экзотермическая реакция, идущая до точки К и сопровождающаяся выделением энергии (теплоты) в количестве ЕА-К. Результирующее количество теплоты, выделившейся при экзотермической реакции, равно
Qэкз=EA-K-E
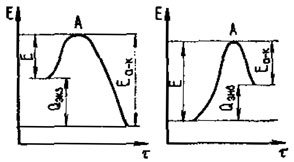
Рис. 82. Энергия реакции горения жидкого топлива
При эндотермической реакции система извне приобретает энергию Е в количестве, большем, чем выделенная энергия ЕА-К, т. е. в результате реакции затрачивается теплота.
В первом приближении количество теплоты активации qα (кДж/кг) можно определить по формуле
qα=см(tυ-tм)+rм+с′р.т.(tсв-tr)+KαV0c′р.в.(tсв-tв),
где см - средняя теплоемкость топлива при температуре испарения, кДж/(кг×град). При tr=325 °С величина см=2,81 кДж/(кг-град); с′р.т - средняя теплоемкость топливных паров кДж/(м>3·град); ср.в-средняя теплоемкость воздуха, кДж/(м3·град); rм - теплота парообразования топлива, кДж/кг (для мазута rм=356 кДж/кг); tr - температура парообразования топлива, °С; tм - температура топлива, поступающего в топку, °С; tсв - температура самовоспламенения топлива, °С (для мазута высшая температура самовоспламенения приблизительно равна 600°С); tв - температура воздуха, поступающего в топку, °С; α - коэффициент избытка воздуха; V0 - теоретическое количество воздуха, необходимое для горения 1 кг топлива, м3/кг; K - коэффициент, учитывающий долю воздуха, необходимую для начала энергетической реакции (принимаем K=0,25).
Для подготовки к сжиганию 1 кг мазута при α=1,36 расход теплоты на активацию факела qα=4085 кДж/кг, т. е. составляет 10% от теплоты сгорания топлива. В действительности же расход теплоты несколько меньше, так как не весь мазут испаряется и не вся масса парообразных углеводородов нагревается до температуры tсв=600°С
Для более благоприятных условий, т. е. когда α=1,1, tв=300°С, V0=10,5 м3/кг и tм=80°С, расход теплоты равен 2514 кДж/кг.
Предварительный подогрев, необходимый для зажигания топлива, первоначально создается внесением в топку горящего факела, искры или другого источника высокой температуры. В дальнейшем частицы горящего топлива, горячие газы, а также накаленные теплоизлучаюшие стенки топочной камеры способствуют подогреву и протеканию реакции горения вновь поступающей топливно-воздушной смеси.
При нагреве жидкого топлива с недостатком воздуха происходит испарение углеводородов и их термическое разложение, сопровождающееся расщеплением углеводородов.
В результате расщепления образуются легкие и тяжелые углеводороды. Легкие углеводороды и водород быстро сгорают при благоприятных условиях (достаточная температура, наличие кислорода). Тяжелые, высокомолекулярные углеводороды и сажистый углерод очень трудно сгорают, вследствие чего значительная несгоревшая их часть уносится из топки либо образует в топках коксовые наросты. Копоть и сажа в пламени также являются результатом образования тяжелых, высокомолекулярных углеводородов.
При достаточном количестве кислорода углеводороды окисляются. Начальная стадия окисления проходит с образованием горячих газов - оксидов углерода и водорода
2СxHy+zO2=mCO+nH2
В результате облегчается конечная стадия горения, проходящего по реакциям:
2CO+O2↔2CO2;
2H2+O2↔2H2O
Таким образом, процесс горения жидкого топлива проходит следующие стадии: смешение капель топлива с воздухом, подогрев их и испарение, термическое разложение (расщепление), образование газовой фазы, воспламенение и завершение оксидирования (горения) газовой фазы. Стадии эти неотделимы одна от другой и в какой-то мере совмещаются.
Образовавшаяся после прохождения первых стадий горения газовая смесь легко воспламеняется и быстро сгорает.
Если процесс нагрева и испарения частиц топлива протекает быстро, то при достаточном количестве кислорода создаются наиболее благоприятные условия для полного горения, в противном случае происходит глубокий распад углеводородов с образованием трудносжигаемых частиц. Мелкое распыление частиц топлива и равномерное их распределение увеличивают активную поверхность реакции, облегчают нагрев и испарение частиц и способствуют процессу быстрого и полного горения.
Разложение углеводородов идет симметрично при сравнительно низких температурах (до 600°С). При более же высоких температурах распад молекул идет несимметрично: наряду с легкими углеводородами образуются тяжелые углеводородные комплексы, наиболее трудносжигаемые. При условии тонкого, равномерного распыления топлива и хорошего смешения его с воздухом, по возможности подогретым, подводе всего воздуха к корню факела создаются наилучшие условия горения жидкого топлива.
Важно также, чтобы образование частиц тяжелых углеводородов и сажистого углерода, неизбежное в той или иной степени, происходило возможно раньше, чтобы частицы не уносились в атмосферу, а успевали полностью сгорать в зоне интенсивного горения.
Таким образом, основные условия эффективного сжигания жидкого топлива сводятся к следующему: необходимо обеспечить подвод всего количества воздуха к устью факела, мелкое и равномерное распыление топлива, тщательное смешение частиц топлива и воздуха, турбулентность потока, подогрев воздуха, высокую температуру и хорошую воспламеняемость топлива в топке.
Подвод воздуха в количествах, теоретически необходимых для горения топлива (стехиометрическая смесь), может обеспечить полное сгорание топлива лишь в случае очень тонкого его распыления и тщательного смешения с воздухом. Поэтому практически воздух подают в количестве, несколько большем, чем это необходимо для создания стехиометрической смеси. Однако во избежание чрезмерного охлаждения смеси избыток воздуха не должен быть слишком большим. При двойном количестве воздуха воспламенение и горение топлива чрезвычайно затрудняется и даже становится невозможным.
Сгорание отдельной капли топлива можно представить следующим образом: в результате подогрева капля начинает испаряться, пары топлива, окружающие каплю, диффундируют в окружающую среду, происходит взаимопроникание частиц воздуха и топлива. Капля, движущаяся относительно окружающей среды, будет иметь в передней части и сбоку более тонкую, а сзади - удлиненную зону горения.
При достаточной температуре смесь паров топлива и кислорода воздуха начинает активно реагировать, происходит процесс диффузионного сгорания газовой фазы топлива. Скорость химической реакции очень велика, скорость же физических процессов (испарение капли, смешение паров топлива с окислителем, подогрев смеси) значительно меньше, и очевидно эти физические процессы определяют скорость сгорания.
В основном время сгорания зависит от времени испарения и времени диффузии молекул. Ламинарная диффузия определяет спокойный, сравнительно медленный процесс, турбулентная - ускоренный процесс. С уменьшением размера капель уменьшается время их испарения. Испаряемость топлива, его плотность, состав и условия теплообмена с окружающей средой также влияют на скорость горения.
Горение жидкого топлива состоит из процессов его распыления, смешения с воздухом (окислителем), испарения и реакции соединения с окислителем.
Величина поверхности частиц топлива, омываемых воздухом и вступающих в реакцию с кислородом, имеет решающее значение для интенсивного и полного сгорания топлива. Величина активно реагирующей поверхности топлива определяется степенью и качеством его распыления, а также качеством смешении его с воздухом. Однородное и тонкое распыление топлива является обязательным и важным фактором подготовки топлива к сжиганию.
Распыление топлива - процесс дробления струи на мелкие капли. Для распыления струи жидкого топлива необходимо преодолеть силы сцепления и поверхностного натяжения.
Для создания развитой поверхности топливных струй применяются следующие методы: распыление топлива сжатым воздухом, паром или дутьевым воздухом от вентилятора; распыление топливной струи за счет действия центробежных сил в механических форсунках; создание тонкой конусовидной пленки вращающимся распылителем в ротационных форсунках; газификация топлива; распределение топлива тонкой пленкой на поверхностях корпуса горелки.
Наиболее совершенное распыление достигается сжатым воздухом или паром, однако для этого требуется компрессор или паровой котел. При распылении топлива дутьевым воздухом также получается хорошее качество распыления, однако здесь необходим вентилятор высокого или среднего давления (не менее 3000 - 4000 Па). Недостатком метода распыления с помощью форсунок является наличие вращающихся механизмов с довольно сложной кинематической передачей в механических форсунках, а в ротационных - еще требуется топливный насос высокого давления, а также система фильтрации топлива.
Все перечисленные способы распыления топлива применяются при расходах топлива не ниже 5 - 10 кг/ч, что существенно превышает потребность в топливе бытовых печей. По этим причинам для установки в бытовых отопительных и отопительно-варочных печах могут быть рекомендованы только методы газификации и распределения топлива тонкой пленкой в корпусе горелки. При этом требуется минимальное количество вспомогательного оборудования, причем расход топлива может быть минимальным.
Для того чтобы обеспечить эффективное протекание процесса горения жидкого топлива, необходимо правильно проводить его теоретический расчет.
При расчетах горения топлива требуется определять следующие величины: количество воздуха, теоретически необходимого для горения; количество образующихся продуктов сгорания; коэффициент избытка воздуха в продуктах сгорания; теоретическую температуру горения.
Точный расчет этих величин производится по данным элементарного состава топлива на основе количественных соотношений реакций горения. Для различных марок жидкого топлива, имеющего достаточно стабильный элементарный состав, выведены упрощенные формулы для расчета процессов горения в следующем виде.
Теоретически необходимое количество воздуха - V0 (м3/кг) подсчитывают по формуле
| V0= | Qнр | +0,007Wp-0,06. |
| 1000 |
Количество продуктов сгорания, образующихся при коэффициенте избытка воздуха α=1 и при действительном коэффициенте - Vг определяют по формулам:
V0г=V0+ΔV;
Vг=αV0+ΔV,
где ΔV - приращение объема продуктов сгорания по сравнению с объемом воздуха, м3/кг.
Величина ΔV может быть определена по формуле
| ΔV=0,12 | Qpн | +0,0124Wp-0,505 |
| 1000 |
или приближенно по формуле
| ΔV=0,12 | Qpн | -0,48 |
| 100 |
Теоретическую температуру горения можно определить по формуле
| t0= | Qнp+Qв | , |
| V0гсг+(α-1)V0св |
где Qв=αV0свtв - теплота, содержащаяся в воздухе, используемом для горения, Вт; сг, св - теплоемкости газов и воздуха при температуре горения, кДж/(м3·град).
Зависимость теплоемкости и объемов газов от величины избытка воздуха показана на рис. 83. Величины сг и св можно определить по графику на рис. 83, а.
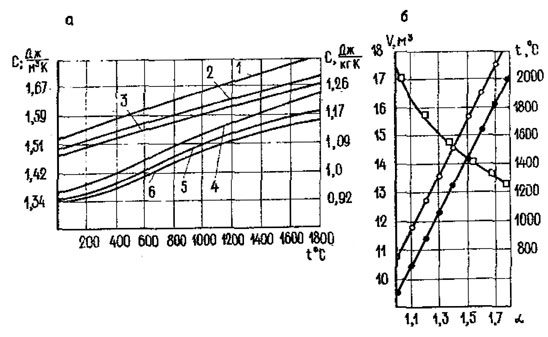
Рис. 83. Зависимость теплоемкости и объемов газов от коэффициента избытка воздуха: а - зависимость теплоемкости газов и воздуха от температуры; б - зависимость объема воздуха продуктов и температуры сгорания от коэффициента избытка воздуха
Определение величины коэффициента избытка воздуха может быть произведено по данным элементарного анализа продуктов сгорания по углекислоте и кислороду но формулам:
| α= | RO2макс | = | CO2макс | , |
| RO2 | CO2+CO+CH4 |
где
| CO2макс= | 21 | ; |
| 1+β |
| α= | 21 | |
| 21-(O2-0,5CO-2CH4) |
при полном сгорании
| α= | 21 | . |
| 21-O2 |
Полное количество азота, внесенного в полном объеме воздуха, равно N2. Количество азота, сопровождающего избыточный кислород, равно
| 79 | O2, | |
| 21 |
следовательно, в теоретическом количестве воздуха содержится
| N2- | 79 | O2 |
| 21 |
азота. Отсюда можно получить приближенную формулу по определению коэффициента избытка воздуха по азоту
| α= | N2 | = | 1 | , |
| N2-79/21*O2 | 1-3,76*O2/N2 |
которую можно представить в следующем виде:
| α= | 79/(RO2)+β | , |
| 3,76+4,76 |
где величина
| β= | 2,37 | (Hp- | Op | ) |
| Cp+0,375*Sp | 8 |
- показатель, зависящий только от элементарного состава топлива.
Для жидкого топлива β=0,36-0,38 (в среднем может быть принято β=0,37). Величина RО2=СО2+СО+СН4 зависит от величин коэффициента избытка воздуха α и химического недожога с горючими СО, СН4, При полном сгорании топлива (СО, СН4=0) R02=СО2.
Таким образом, определив с помощью газового анализа содержание СО2 и О2 в продуктах сгорания можно по одной из приведенных формул подсчитать величину коэффициента избытка воздуха.
Согласно выведенным зависимостям, основные характеристики продуктов сгорания жидкого топлива определяются величиной α. На рис. 83, б показаны зависимости объемов воздуха, необходимого для горения продуктов сгорания и температуры сгорания от величины α.
Рассмотрим пример расчета температуры сгорания топлива.
Пример. Жидкие топливо имеет следующий состав: Ср=83%, Нp=13%, Sp=0,6%, Оp+Np=1,4%, Wp=2%. Коэффициент избытка воздуха α=1,2.
Теплота сгорания
Qнp=81Cp+246·Hp+26(Sp-Op)-6·Wp=81·83+246·13+26(0,6-1,4)-6·2=413997 кДж/кг
Теоретически необходимое для горения количество воздуха
| V0= | 9880 | +0,007·2-0,06=9,81 м3/кг |
| 1000 |
Действительное количество воздуха
αV0=9880/1000+0,007*2-0,06=9,81 м3/кг
Приращение объема продуктов сгорания
ΔV=0,12*9880/1000-0,0124*2-0,505=0,695 м3/кг.
Количество продуктов сгорания
Vг=αV0+ΔV=11,8+0,695=12,495 м3/кг.
Для определения теоретической температуры сгорания предварительно зададимся ее величиной t0=2000°C и по графику на рис. 83, а найдем для газов cг=1,68 кДж/(м3-град). для воздуха св=1,51 кДж/(м3·град), Температура воздуха tв=25°С, св=1,26 кДж (м3·град).
Предварительная величина температуры сгорания 2000°С
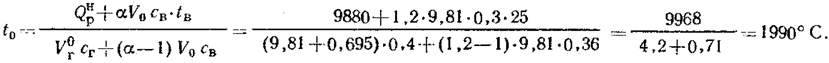
Эта температура близка к предварительно принятой, поэтому пересчета не требуется.
|
ПОИСК:
|
© BANI-I-SAUNI.RU, 2010-2020
При использовании материалов сайта активная ссылка обязательна:
http://bani-i-sauni.ru/ 'Бани и сауны'
При использовании материалов сайта активная ссылка обязательна:
http://bani-i-sauni.ru/ 'Бани и сауны'